Configuración electrónica
¿Alguna vez te has preguntado por qué el oro es tan diferente del oxígeno o por qué el sodio reacciona violentamente con el agua? Detrás de estas diferencias y comportamientos se encuentra la configuración electrónica. Al conocer este código, no solo comprendemos las propiedades únicas de cada elemento, sino que también abrimos la puerta a entender la esencia misma de la materia. Al finalizar este artículo obtendras toda la información necesaria.
Tabla de contenidos
¿Qué es la Configuración Electrónica?
La configuración electrónica es una descripción detallada de cómo los electrones están organizados en los diferentes niveles y subniveles de energía dentro de un átomo. Esta organización no es aleatoria; sigue un patrón específico y es fundamental para determinar las propiedades químicas y físicas de un elemento.
Cada átomo está compuesto por un núcleo central, que contiene protones y neutrones, y electrones que giran alrededor de este núcleo en regiones definidas llamadas orbitales. Estos orbitales están agrupados en niveles y subniveles de energía. Cada nivel de energía puede contener un número específico de electrones, y dentro de cada nivel, hay subniveles designados como s, p, d y f, que también tienen capacidades específicas para albergar electrones.

La configuración electrónica, por lo tanto, es una forma de representar cómo los electrones están distribuidos en sus respectivos niveles y subniveles. Al conocer esta distribución, los científicos pueden predecir cómo un átomo interactuará con otros átomos, qué tipo de enlaces químicos puede formar y qué propiedades tendrá un elemento o compuesto en particular.
Representación de la configuración electronica
Escribir la configuración electrónica de un átomo implica representar cómo están distribuidos sus electrones en los diferentes niveles y subniveles de energía. Esta distribución sigue una serie de reglas y principios que garantizan que los electrones ocupen los lugares más estables posibles. A continuación, te guiaré paso a paso en este proceso:
- Niveles y Subniveles de Energía: Los electrones se organizan en niveles de energía, que se representan con números enteros (1, 2, 3,…). Cada nivel tiene subniveles designados como s, p, d y f.
- Capacidad de los Subniveles: Cada subnivel tiene una capacidad máxima de electrones que puede albergar:
- s: 2 electrones
- p: 6 electrones
- d: 10 electrones
- f: 14 electrones
- Orden de Llenado: Los electrones llenan los subniveles en un orden específico, buscando siempre la posición de menor energía. El orden generalmente es: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, y así sucesivamente.
- Notación: Para escribir la configuración electrónica, se utiliza el número del nivel de energía, seguido de la letra del subnivel y un superíndice que indica la cantidad de electrones en ese subnivel.
- Electrones de Valencia: Son los electrones en el nivel de energía más externo de un átomo. Estos electrones son especialmente importantes porque son los que participan en las reacciones químicas y en la formación de enlaces.
- Configuración Electrónica Abreviada: Para átomos con muchos electrones, escribir la configuración completa puede ser tedioso. En estos casos, se puede usar una notación abreviada utilizando el gas noble anterior al elemento en cuestión.
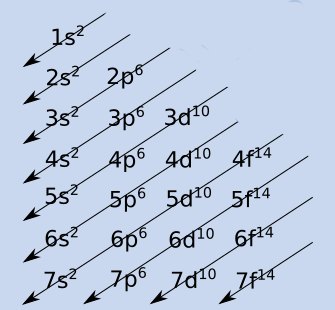
¿Cómo se utiliza el Diagrama de Moeller para hacer configuraciones electronicas?
El Diagrama de Moeller es una herramienta visual que ayuda a determinar el orden en el que se llenan los orbitales. Se dibuja una serie de diagonales que representan los diferentes subniveles de energía. Siguiendo el diagrama de arriba hacia abajo y de izquierda a derecha, se puede determinar el orden en el que se llenan los orbitales. En la siguiente imagen vas a poder verlo de forma visual:
Reglas de configuración de los electrones
Existen reglas específicas que guían la distribución de los electrones en los orbitales:
- Regla de Aufbau (Principio de construcción): Eestablece que los electrones llenan primero los orbitales de menor energía antes de pasar a los de mayor energía. En la práctica, esto significa que los electrones se distribuyen en los orbitales en un orden específico: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, y así sucesivamente.
- Principio de exclusión de Pauli: Cada orbital puede contener como máximo dos electrones, y estos deben tener espines opuestos. El espín es una propiedad cuántica de los electrones y puede tener dos valores posibles, generalmente representados como +½ y -½.
- Regla de Hund (Regla de máxima multiplicidad): Establece que los electrones se distribuyen de manera uniforme entre los orbitales de un subnivel antes de que dos electrones ocupen el mismo orbital. Esta distribución maximiza la repulsión entre electrones, lo que a su vez maximiza la estabilidad del átomo.
Ejemplos de Configuración electrónica
+ Ejercicios resueltos de configuraciones electrónicas
Hidrógeno (H): Z = 1:
- El hidrógeno tiene un solo electrón. Siguiendo la regla de Aufbau, este electrón ocupará el orbital de menor energía disponible.
- Configuración electrónica: 1s¹
Helio (He): Z = 2:
- El helio tiene dos electrones. Ambos electrones se ubicarán en el orbital 1s, que es el de menor energía.
- Configuración electrónica: 1s²
Carbono (C): Z = 6
- El carbono tiene seis electrones. Siguiendo el orden de llenado, los primeros dos electrones ocuparán el orbital 1s, los siguientes dos el 2s, y los dos restantes se distribuirán en los orbitales 2p.
- Configuración electrónica: 1s² 2s² 2p²
Potasio (K): Z = 19
- El potasio tiene 19 electrones. Siguiendo el orden de llenado, los primeros 18 electrones llenarán los orbitales 1s, 2s, 2p, 3s, 3p y 4s. El electrón restante se ubicará en el siguiente orbital disponible, que es 4s.
- Configuración electrónica: 1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹
Excepciones a la configuración electrónica
Aunque la mayoría de los elementos siguen las reglas de configuración electrónica que hemos discutido, existen algunas notables excepciones. Estas excepciones se deben a la naturaleza de los electrones y a cómo buscan la máxima estabilidad dentro del átomo. A continuación, se detallan algunas de estas excepciones:
- Cromo (Cr) Z = 24:
- Según las reglas estándar, esperaríamos que la configuración electrónica del cromo fuera 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d⁴. Sin embargo, en la realidad, el cromo tiene la configuración 1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹ 3d⁵.
- Esto se debe a que un subnivel d medio lleno (con 5 electrones) es más estable que uno con 4 electrones. El cromo «sacrifica» un electrón del 4s para llenar parcialmente el 3d.
- Cobre (Cu) Z= 29:
- Siguiendo las reglas estándar, esperaríamos que la configuración electrónica del cobre fuera 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d⁹. Sin embargo, en la realidad, el cobre tiene la configuración 1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹ 3d¹⁰.
- Al igual que con el cromo, un subnivel d completamente lleno (con 10 electrones) es más estable. El cobre «sacrifica» un electrón del 4s para llenar completamente el 3d.
- Elementos de la serie lantánida y actínida: Presentan excepciones debido a las complejidades asociadas con la energía de los orbitales f y su interacción con otros orbitales.
Tabla con todas las configuraciones electronicas
| Z | Elemento | Configuración electronica | Reducida |
| 1 | Hidrógeno (H) | 1s1 | 1s1 |
| 2 | Helio (He) | 1s2 | 1s2 |
| 3 | Litio (Li) | 1s2 2s1 | [He] 2s1 |
| 4 | Berilio (Be) | 1s2 2s2 | [He] 2s2 |
| 5 | Boro (B) | 1s2 2s2 2p1 | [He] 2s2 2p1 |
| 6 | Carbono (C) | 1s2 2s2 2p2 | [He] 2s2 2p2 |
| 7 | Nitrógeno (N) | 1s2 2s2 2p3 | [He] 2s2 2p3 |
| 8 | Oxígeno (O) | 1s2 2s2 2p4 | [He] 2s2 2p4 |
| 9 | Flúor (F) | 1s2 2s2 2p5 | [He] 2s2 2p5 |
| 10 | Neón (Ne) | 1s2 2s2 2p6 | [He] 2s2 2p6 |
| 11 | Sodio (Na) | 1s2 2s2 2p6 3s1 | [Ne] 3s1 |
| 12 | Magnesio (Mg) | 1s2 2s2 2p6 3s2 | [Ne] 3s2 |
| 13 | Aluminio (Al) | 1s2 2s2 2p6 3s2 3p1 | [Ne] 3s2 3p1 |
| 14 | Silicio (Si) | 1s2 2s2 2p6 3s2 3p2 | [Ne] 3s2 3p2 |
| 15 | Fósforo (P) | 1s2 2s2 2p6 3s2 3p3 | [Ne] 3s2 3p3 |
| 16 | Azufre (S) | 1s2 2s2 2p6 3s2 3p4 | [Ne] 3s2 3p4 |
| 17 | Cloro (Cl) | 1s2 2s2 2p6 3s2 3p5 | [Ne] 3s2 3p5 |
| 18 | Argón (Ar) | 1s2 2s2 2p6 3s2 3p6 | [Ne] 3s2 3p6 |
| 19 | Potasio (K) | 1s2 2s2 2p6 3s2 3p6 4s1 | [Ar] 4s1 |
| 20 | Calcio (Ca) | 1s2 2s2 2p6 3s2 3p6 4s2 | [Ar] 4s2 |
| 21 | Escandio (Sc) | 1s2 2s2 2p6 3s2 3p6 4s2 3d1 | [Ar] 4s2 3d1 |
| 22 | Titanio (Ti) | 1s2 2s2 2p6 3s2 3p6 4s2 3d2 | [Ar] 4s2 3d2 |
| 23 | Vanadio (V) | 1s2 2s2 2p6 3s2 3p6 4s2 3d3 | [Ar] 4s2 3d3 |
| 24 | Cromo (Cr) | 1s2 2s2 2p6 3s2 3p6 4s1 3d5 | [Ar] 4s1 3d5 |
| 25 | Manganeso (Mn) | 1s2 2s2 2p6 3s2 3p6 4s2 3d5 | [Ar] 4s2 3d5 |
| 26 | Hierro (Fe) | 1s2 2s2 2p6 3s2 3p6 4s2 3d6 | [Ar] 4s2 3d6 |
| 27 | Cobalto (Co) | 1s2 2s2 2p6 3s2 3p6 4s2 3d7 | [Ar] 4s2 3d7 |
| 28 | Níquel (Ni) | 1s2 2s2 2p6 3s2 3p6 4s2 3d8 | [Ar] 4s2 3d8 |
| 29 | Cobre (Cu) | 1s2 2s2 2p6 3s2 3p6 4s1 3d10 | [Ar] 4s1 3d10 |
| 30 | Zinc (Zn) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 | [Ar] 4s2 3d10 |
| 31 | Galio (Ga) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p1 | [Ar] 4s2 3d10 4p1 |
| 32 | Germanio (Ge) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p2 | [Ar] 4s2 3d10 4p2 |
| 33 | Arsénico (As) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p3 | [Ar] 4s2 3d10 4p3 |
| 34 | Selenio (Se) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p4 | [Ar] 4s2 3d10 4p4 |
| 35 | Bromo (Br) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5 | [Ar] 4s2 3d10 4p5 |
| 36 | Kriptón (Kr) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 | [Ar] 4s2 3d10 4p6 |
| 37 | Rubidio (Rb) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 | [Kr] 5s1 |
| 38 | Estroncio (Sr) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 | [Kr] 5s2 |
| 39 | Itrio (Y) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d1 | [Kr] 5s2 4d1 |
| 40 | Zirconio (Zr) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d2 | [Kr] 5s2 4d2 |
| 41 | Niobio (Nb) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d4 | [Kr] 5s1 4d4 |
| 42 | Molibdeno (Mo) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d5 | [Kr] 5s1 4d5 |
| 43 | Tecnecio (Tc) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d5 | [Kr] 5s2 4d5 |
| 44 | Rutenio (Ru) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d7 | [Kr] 5s1 4d7 |
| 45 | Rodio (Rh) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d8 | [Kr] 5s1 4d8 |
| 46 | Paladio (Pd) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 4d10 | [Kr] 4d10 |
| 47 | Plata (Ag) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d10 | [Kr] 5s1 4d10 |
| 48 | Cadmio (Cd) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 | [Kr] 5s2 4d10 |
| 49 | Indio (In) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p1 | [Kr] 5s2 4d10 5p1 |
| 50 | Estaño (Sn) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p2 | [Kr] 5s2 4d10 5p2 |
| 51 | Antimonio (Sb) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p3 | [Kr] 5s2 4d10 5p3 |
| 52 | Telurio (Te) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p4 | [Kr] 5s2 4d10 5p4 |
| 53 | Yodo (I) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p5 | [Kr] 5s2 4d10 5p5 |
| 54 | Xenón (Xe) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 | [Kr] 5s2 4d10 5p6 |
| 55 | Cesio (Cs) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s1 | [Xe] 6s1 |
| 56 | Bario (Ba) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 | [Xe] 6s2 |
| 57 | Lantano (La) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 5d1 | [Xe] 6s2 5d1 |
| 58 | Cerio (Ce) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f1 5d1 | [Xe] 6s2 4f1 5d1 |
| 59 | Praseodimio (Pr) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f3 | [Xe] 6s2 4f3 |
| 60 | Neodimio (Nd) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f4 | [Xe] 6s2 4f4 |
| 61 | Prometio (Pm) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f5 | [Xe] 6s2 4f5 |
| 62 | Samario (Sm) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f6 | [Xe] 6s2 4f6 |
| 63 | Europio (Eu) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f7 | [Xe] 6s2 4f7 |
| 64 | Gadolinio (Gd) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f7 5d1 | [Xe] 6s2 4f7 5d1 |
| 65 | Terbio (Tb) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f9 | [Xe] 6s2 4f9 |
| 66 | Disprosio (Dy) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f10 | [Xe] 6s2 4f10 |
| 67 | Holmio (Ho) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f11 | [Xe] 6s2 4f11 |
| 68 | Erbio (Er) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f12 | [Xe] 6s2 4f12 |
| 69 | Tulio (Tm) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f13 | [Xe] 6s2 4f13 |
| 70 | Iterbio (Yb) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 | [Xe] 6s2 4f14 |
| 71 | Lutecio (Lu) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d1 | [Xe] 6s2 4f14 5d1 |
| 72 | Hafnio (Hf) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d2 | [Xe] 6s2 4f14 5d2 |
| 73 | Tántalo (Ta) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d3 | [Xe] 6s2 4f14 5d3 |
| 74 | Wolframio (W) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d4 | [Xe] 6s2 4f14 5d4 |
| 75 | Renio (Re) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d5 | [Xe] 6s2 4f14 5d5 |
| 76 | Osmio (Os) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d6 | [Xe] 6s2 4f14 5d6 |
| 77 | Iridio (Ir) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d7 | [Xe] 6s2 4f14 5d7 |
| 78 | Platino (Pt) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s1 4f14 5d9 | [Xe] 6s1 4f14 5d9 |
| 79 | Oro (Au) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s1 4f14 5d10 | [Xe] 6s1 4f14 5d10 |
| 80 | Mercurio (Hg) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 | [Xe] 6s2 4f14 5d10 |
| 81 | Talio (Tl) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p1 | [Xe] 6s2 4f14 5d10 6p1 |
| 82 | Plomo (Pb) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p2 | [Xe] 6s2 4f14 5d10 6p2 |
| 83 | Bismuto (Bi) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p3 | [Xe] 6s2 4f14 5d10 6p3 |
| 84 | Polonio (Po) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p4 | [Xe] 6s2 4f14 5d10 6p4 |
| 85 | Astato (At) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p5 | [Xe] 6s2 4f14 5d10 6p5 |
| 86 | Radón (Rn) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 | [Xe] 6s2 4f14 5d10 6p6 |
| 87 | Francio (Fr) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s1 | [Rn] 7s1 |
| 88 | Radio (Ra) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 | [Rn] 7s2 |
| 89 | Actinio (Ac) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 6d1 | [Rn] 7s2 6d1 |
| 90 | Torio (Th) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 6d2 | [Rn] 7s2 6d2 |
| 91 | Protactinio (Pa) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f2 6d1 | [Rn] 7s2 5f2 6d1 |
| 92 | Uranio (U) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f3 6d1 | [Rn] 7s2 5f3 6d1 |
| 93 | Neptunio (Np) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f4 6d1 | [Rn] 7s2 5f4 6d1 |
| 94 | Plutonio (Pu) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f6 | [Rn] 7s2 5f6 |
| 95 | Americio (Am) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f7 | [Rn] 7s2 5f7 |
| 96 | Curio (Cm) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f7 6d1 | [Rn] 7s2 5f7 6d1 |
| 97 | Berkelio (Bk) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f9 | [Rn] 7s2 5f9 |
| 98 | Californio (Cf) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f10 | [Rn] 7s2 5f10 |
| 99 | Einstenio (Es) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f11 | [Rn] 7s2 5f11 |
| 100 | Fermio (Fm) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f12 | [Rn] 7s2 5f12 |
| 101 | Mendelevio (Md) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f13 | [Rn] 7s2 5f13 |
| 102 | Nobelio (No) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 | [Rn] 7s2 5f14 |
| 103 | Lawrencio (Lw) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 7p1 | [Rn] 7s2 5f14 7p1 |
| 104 | Rutherfordio (Rf) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d2 | [Rn] 7s2 5f14 6d2 |
| 105 | Dubnio (Db) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d3 | [Rn] 7s2 5f14 6d3 |
| 106 | Seaborgio (Sg) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d4 | [Rn] 7s2 5f14 6d4 |
| 107 | Bohrio (Bh) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d5 | [Rn] 7s2 5f14 6d5 |
| 108 | Hasio (Hs) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d6 | [Rn] 7s2 5f14 6d6 |
| 109 | Meitnerio (Mt) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d7 | [Rn] 7s2 5f14 6d7 |
| 110 | Darmstatio (Ds) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s1 5f14 6d9 | [Rn] 7s1 5f14 6d9 |
| 111 | Roentgenio (Rg) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s1 5f14 6d10 | [Rn] 7s1 5f14 6d10 |
| 112 | Copernicio (Cn) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 | [Rn] 7s2 5f14 6d10 |
| 113 | Nihonio (Nh) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p1 | [Rn] 7s2 5f14 6d10 7p1 |
| 114 | Flerovio (Fl) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p2 | [Rn] 7s2 5f14 6d10 7p2 |
| 115 | Moscovio (Mc) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p3 | [Rn] 7s2 5f14 6d10 7p3 |
| 116 | Livermorio (Lv) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p4 | [Rn] 7s2 5f14 6d10 7p4 |
| 117 | Teneso (Ts) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p5 | [Rn] 7s2 5f14 6d10 7p5 |
| 118 | Oganesón (Og) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6 | [Rn] 7s2 5f14 6d10 7p6 |
Puntos clave de la Configuraciones electrónicas de los átomos
- La configuración electrónica describe la disposición de los electrones en un átomo.
- Los electrones se distribuyen en orbitales siguiendo reglas específicas.
- El Diagrama de Moeller ayuda a determinar el orden de llenado de los orbitales.
- Existen excepciones a las reglas generales de configuración electrónica.