Reacciones reversibles: Que son, ejemplos y características
Las reacciones reversibles son protagonistas en el mundo de la química. Estos procesos, donde reactivos y productos se encuentran en un sutil equilibrio, son mucho más que cambios moleculares. Las reacciones reversibles se encuentran presentes desde la síntesis de compuestos industriales hasta las reacciones bioquímicas en nuestro organismo. A lo largo de este artículo, trataremos de conocer más de cerca a las reacciones reversibles.
Tabla de contenidos
¿Qué es una reacción reversible?
Una reacción reversible es un tipo de proceso químico en el cual los productos formados pueden revertir a los reactivos originales. En otras palabras, en una reacción reversible, la transformación química puede ocurrir tanto de reactivos a productos como de productos a reactivos.
A diferencia de las reacciones irreversibles, donde los reactivos se convierten en productos de manera unidireccional, en las reacciones reversibles los productos no se forman de manera definitiva. En su lugar, se establece un equilibrio dinámico entre la formación de los productos y la regeneración de los reactivos.
Este equilibrio no implica que las cantidades de reactivos y productos sean iguales, sino que las velocidades de las reacciones directa (reactivos a productos) e inversa (productos a reactivos) son las mismas. Por lo tanto, las concentraciones de reactivos y productos permanecen constantes en un sistema cerrado a lo largo del tiempo.
Las reacciones reversibles son comunes tanto en procesos naturales como en la industria química. Un ejemplo destacado es la síntesis del amoníaco en el proceso Haber-Bosch, crucial para la producción de fertilizantes. En la naturaleza, muchas reacciones bioquímicas, como la unión del oxígeno a la hemoglobina en la sangre, son reversibles, permitiendo procesos biológicos complejos y regulados.
¿Qué es una reacción química?
Durante una reacción química, los enlaces entre los átomos en los reactivos se rompen y se forman nuevos enlaces para crear los productos. Las reacciones reversibles son, de hecho, un tipo de reacción química.
Este proceso puede ser simple, involucrando solo unos pocos átomos, o increíblemente complejo, como en las reacciones bioquímicas dentro de las células vivas.
¿Cómo sabemos que una reacción química está ocurriendo? puede ser que los colores cambien, que aparezca una sustancia sólida, que se libere o absorba calor, o que se produzca gas.
Hay una regla muy importante: la ley de conservación de la masa. Esto significa que la cantidad total de materia antes de la reacción es igual a la cantidad después.
¿Cómo se representa una reacción reversible en una ecuación química?
La representación de reacciones químicas se realiza mediante ecuaciones químicas, descripciones simbólicas de estos procesos. Para las reacciones reversibles, la representación difiere de las irreversibles.
En ecuaciones químicas estándar, las flechas indican la dirección de la reacción. En reacciones reversibles, se emplea una doble flecha (⇌). La doble flecha señala un sistema en equilibrio, indicando que la formación de productos y su posible descomposición deben considerarse. Esto es esencial para prever el comportamiento bajo distintas condiciones, como cambios en concentración, temperatura o presión.
Ejemplo de reacción reversible
Por ejemplo, consideremos la reacción reversible de la formación de yodo hidruro a partir de hidrógeno e yodo:
H2(g)+I2(g)⇌2HI(g)
En esta ecuación, el hidrógeno (H2) y el yodo (I2) reaccionan para formar yodo hidruro (HI), pero el yodo hidruro también puede descomponerse de nuevo en hidrógeno e yodo. La doble flecha indica que tanto la formación de HI como su descomposición pueden ocurrir.
Constante de equilibrio y reacción reversible
La constante de equilibrio se define para una reacción reversible dada en su estado de equilibrio. Matemáticamente, se expresa como el producto de las concentraciones de los productos elevadas a la potencia de sus coeficientes estequiométricos, dividido por el producto de las concentraciones de los reactivos, también elevadas a la potencia de sus coeficientes estequiométricos.
aA+bB⇌cC+dD
la constante de equilibrio K se calcula como:
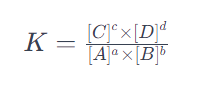
donde [A],b[B], [C], y [D] representan las concentraciones de equilibrio de los reactivos y productos, y a, b, c, y d son sus respectivos coeficientes estequiométricos en la ecuación balanceada.
¿Qué factores afectan al equilibrio en una reacción reversible?
El equilibrio en una reacción reversible es un estado dinámico donde las velocidades de las reacciones directa e inversa son iguales, manteniendo concentraciones constantes de reactivos y productos. Diversos factores pueden afectar este equilibrio, alterando las concentraciones relativas y, por ende, la dirección de la reacción. Estos factores incluyen la concentración, temperatura, presión (en reacciones con gases) y la presencia de catalizadores.
- Concentración: cambios en la concentración de reactivos o productos pueden desplazar el equilibrio. Según el principio de Le Chatelier, si se añade más de un componente, el equilibrio se desplazará para contrarrestar este cambio, favoreciendo la reacción que reduce su concentración.
- Temperatura: la temperatura influye significativamente. Aumentarla suele favorecer la reacción endotérmica, desplazando el equilibrio hacia los productos, mientras que disminuir la temperatura favorece la reacción exotérmica.
- Presión: en reacciones con gases, ajustar la presión puede modificar el equilibrio. Incrementarla favorece la dirección con menos moles de gas, y disminuirla favorece la dirección con más moles.
- Catalizadores: aunque aceleran ambas direcciones de la reacción, los catalizadores no alteran la posición del equilibrio. Su función principal es aumentar la velocidad para llegar al equilibrio.
¿Puede una reacción reversible alcanzar un estado de equilibrio dinámico en condiciones no estándar?
Una reacción reversible puede alcanzar un estado de equilibrio dinámico bajo una amplia variedad de condiciones, no sólo en condiciones estándar. Este estado de equilibrio dinámico es una característica distintiva de las reacciones reversibles y puede establecerse en diferentes condiciones de temperatura, presión y concentración.
El equilibrio dinámico es adaptable. Cuando las condiciones externas cambian, el equilibrio se desplaza para acomodar esos cambios, según el principio de Le Chatelier. Esto significa que, aunque las condiciones específicas en las que se alcanza el equilibrio pueden variar, el sistema siempre buscará un nuevo equilibrio en respuesta a los cambios externos.


